基于使用稳定同位素标记试剂盒(NBS试剂)的相对比较定量法的大肠癌特异性生物标记物
介绍基于使用定量的蛋白质解析用稳定同位素标记试剂盒(NBS试剂:13CNBS® Stable Isotope Labeling Kit-N)的相对比较定量法的大肠癌特异性生物标记物发现例。
(实验·研究流程)
1.从来自大肠癌患者的大肠正常部位及大肠癌病变部位(各30~50mg)组织提取蛋白质,主要分为细胞质中局部存在蛋白质的可溶性分离制备和包括细胞膜中局部存在蛋白质在内的不溶性分离制备。。
2.对于来自正常部位的蛋白质使用轻试剂(12C-NBS)、对于来自癌部的蛋白质使用重试剂(13C-NBS)分别进行稳定同位素标记。
3. 混合标记的蛋白质样品,使用胰蛋白酶进行酶切,使用纳升LC分离得到的肽。
4使用MALDI样品板用点样装置(AccuSpot),直接将来自纳升LC的洗脱液点制备到MALDI样品板上。
5.对于这些上样在384孔MALDI样品板上的分离制备的样品,使用MALDI-TOFMS(AXIMA系列)的自动测定模式进行MS测定。
6.对于获得的MS数据,使用定量的蛋白质解析支援软件 TWIP进行定量解析,选择变动大的应关注的峰。
7.对于以TWIP选择的峰进一步进行MS/MS测定,通过Mascot检索(MS/MS 离子检索)鉴定蛋白质。
(结果)
对于使用TWIP检测出的具有6Da差的约3000对峰,从中选择在70%以上的病例中癌部位/正常部位的峰离子强度比之在±1.5倍以上的峰(320对),使用Mascot检索(MS/MS离子检索)鉴定了差异蛋白质。
综合可溶性分离与不溶性分离检测的结果,对于大肠癌组织中表达亢进的71种、大肠癌组织中表达低下的57种共计128种蛋白质进行了鉴定。其中,98种蛋白质是新鉴定到的与大肠癌相关的蛋白质1)。
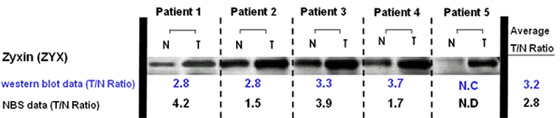
图1:基于免疫印迹解析的表达变动确认例 N : 正常部位 / T : 癌病变部位
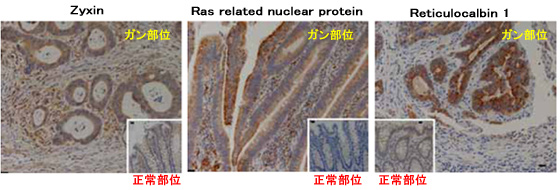
图2:基于免疫组织化学染色的各蛋白质在大肠组织中表达模式的评价
对于检测出的标记候补蛋白质,通过抗体的免疫印迹解析、免疫组织化学染色,确认/评价了使用NBS试剂得到的伴随癌病变的蛋白质表达变动结果。
图1表示在癌部位表达亢进的蛋白质之一Zyxin的免疫印迹解析结果。除了Zyxin,Reticulocalbin 1,Galectin-1,Ras related nuclear protein,Vimentin,S-adenosylhomocysteine hydrolase等许多蛋白质都获得了与使用NBS试剂的定量结果相一致的结果,验证了使用NBS试剂的定量评价的可靠性。并且,通过免疫组织化学染色,还评价了这些大肠癌上可见表达亢进的标记候补蛋白质主要是在癌病变组织的哪个部位上表达的,确认了局部存在于癌细胞、间质细胞的表达亢进(图2)。除本例之外,肾癌也通过使用NBS试剂的解析鉴定了多个标记候补蛋白质2)。
使用NBS试剂的生物标记物发现系统在诸如上述使用临床检体的解析中也验证了其有效性,对于疾病特异性生物标记物发现等生物样品中的微量标记候补蛋白质的高灵敏度检测卓有成效。
参考资料
1) Watanabe, M., Takemasa, I. et al. (2008). "An application of the 2-nitrobenzenesulfenyl method to proteomic profiling of human colorectal carcinoma: A novel approach for biomarker discovery." Proteomics Clin.Appl.2(6): 925-935.
2) Okamura, N., Masuda, T. et al. (2008). “Quantitative proteomic analysis to discover potential diagnostic markers and therapeutic targets in human renal cell carcinoma.” Proteomics 8: 3194-3203.
